

(中国器审 2023-10-19)
一、项目背景
随着互联网与人工智能的快速发展,医疗行业涌现了越来越多的医用软件(Software as Medical Device,SaMD)。各国监管机构在积极地调整法规和监管方向,力求鼓励创新的同时保证患者安全。
2017年8月1日,FDA发布了数字健康创新行动计划(Digital Health Innovation Action Plan,DHIAP),并开始试行数字健康与认证试点项目(Precertification, Pre-Cert)。先后发布了《软件预认证计划:2019年测试计划》(Software Precertification Program: 2019 Test Plan)、《开展软件预认证试点计划的监管框架》(Software Precertification Program: Regulatory Framework for Conducting the Pilot Program within Current Authorities)、《开发软件预认证计划的工作模式》(Developing a Software Precertification Program: A Working Model)等文件。
多达上百家公司申请参与试点项目,经筛选最终入围的企业有9家,分别是:苹果、Fitbit、三星电子、谷歌旗下的生命科技公司Verily、强生、罗氏公司,以及三家相对规模较小的数字医疗公司:Pear Therapeutics、Phosphorus和Tidepool。
二、项目概述
软件预认证计划旨在建立一种自愿的监管途径,该途径表现为用一种比当前监管模式更为定制化的监管模型来评估软件技术的安全性和有效性,为医用软件提供更多简化和高效的监管模式。
该计划的目标是通过评估组织的卓越性,建立对其产品的信任,进而简化上市前审查程序,并利用上市后数据来验证SaMD在真实世界中的持续安全性、有效性和性能,从而实现定制化的、务实的、负担最小的、精简有效的监管监督。
预认证更多针对的是组织而不是单独的产品。预认证过程将考察组织是否能生产高质量、安全和有效的SaMD,以此确定该组织是否能获得预认证。获得预认证的组织,其软件产品可以简化或免于某些上市前提交要求,减少单个产品审查负担,更快推向市场。
三、预认证项目
预认证项目主要包括四部分内容,即卓越性评价,审评路径判定,简化审评和真实世界性能评估。四部分相互依赖,体现了产品全生命周期的方法,该方法能覆盖软件产品从上市前开发到上市后性能的全过程评估和监控。
(一)卓越性评价
该工作旨在确定用于评价预认证组织卓越性的客观标准和方法,并决定是否可以维持其预认证状态。
卓越性评价包括4个过程:1.建立预认证计划参考系。确定可以用来考察组织卓越性的具体领域和影响SaMD全生命周期安全和有效的要素。2.组织定义和提供其过程和活动,以及保证过程和活动质量的关键衡量和指标(KPI)。3.评价组织提出的过程和活动能否通过1中的要素展现出其卓越性、KPI是否合适和充分。4.针对每条卓越原则汇总评价结果,决定组织最终的预认证水平;评价要素体现卓越原则的方法是否有效等。
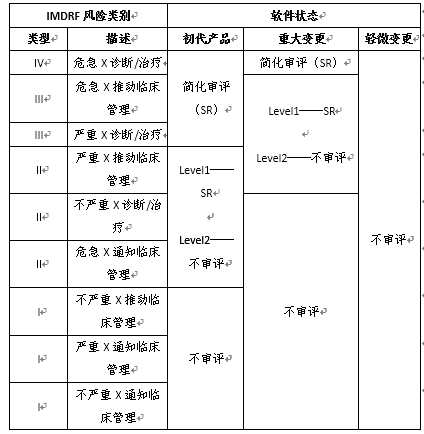
根据组织的能力,认定结果分为两个级别:1.Level 1预认证,允许组织开发和销售较低风险的软件而无需审查,同时要求对其他类型的软件进行精简审查,适用于在软件产品方面没有经验或经验有限的组织。2.Level 2预认证,允许组织开发和销售较低风险的软件和中等风险的软件而无需审查,同时要求对其他类型的软件进行精简审查,适用于在软件方面有丰富经验的组织。
(二)审评路径判定
该工作旨在制定基于风险的审评路径判定框架,以便经过预认证的公司可以确定其产品的上市前审核途径。
对预认证组织的SaMD产品的上市前审查将依据该组织的预认证状态、预认证级别和SaMD的风险类别来确定。软件生产商需要根据国际医疗器械监管机构论坛(IMDRF)发布的指南来判断产品所属类别并提交SaMD定义声明。内容包括:1.SaMD提供的信息对医疗保健决策的重要性;2.医疗保健状况或状态;3.软件的核心功能描述等。
各级别预认证组织生产SaMD的审评路径如下表所示:
(三)简化审评
该工作旨在确定上市前评审所必需的要素,并制定上市前评审流程以为预认证组织提供软件产品安全性和有效性的合理保证。
为了确保安全和有效的三大类要素如下表:

简化审评采取一般性的交互评审方式加快评审速度。在上市前审查中,将对软件分析性能、临床性能、合适的安全方法进行交互式审评。交互式审评能够尽早介入,利于暴露潜在问题并及时交流解决。同时,审评流程尽可能自动化,减少审查时间。
(四)真实世界性能评估
该工作旨在确定经过预认证的公司会收集和分析访问上市后数据,并使用这些现成的数据分析来验证预认证后的持续卓越表现,识别新出现的安全和网络安全风险,向项目的其他组件提供关键反馈,支持产品的监管状态以及新的和不断发展的产品功能,并支持适当使用上市后数据生成临床证据。
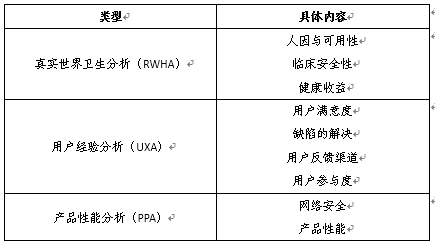
真实世界性能分析(RWPA)是指与预认证组织销售的SaMD产品在实际环境中的安全性、有效性和性能相关的数据的系统计算分析。其可以有效地生成、收集和分析来自适当仪器化SaMD产品的数据,以及来自设备注册、结构良好的数据共享和其他电子健康信息来源,包括患者注册和目前正在开发的国家卫生技术评估系统(NEST)的真实数据。
真实世界性能分析包括真实世界卫生分析(RWHA)、用户经验分析(UXA)、产品性能分析(PPA)。
组织需要建立数据的收集计划并保持持续的监测。真实世界性能收集计划侧重趋势和总结分析而非原始数据。鼓励组织制定真实世界性能分析计划,明确需要收集的真实世界性能数据元素、数据收集频率,并为每个数据元素设定目标。交互式审查和同意后,组织执行计划并分享结果给FDA,FDA会在合适的验证分析类型方面提供进一步指导。
四、总结与分析
FDA在预认证项目中针对医用软件提出了新的监管框架:从认证组织到审评产品,利用现有申报通道让部分中低风险医用软件产品获得更精简的上市许可路径,以支持和鼓励医用软件产品创新。
从投入和收益来看,预认证对于生产多品类医用软件产品的组织来说能够简化对组织要素的重复考察,加快迭代产品的上市,收益更加明显。
此外,在省局开展的优化第二类医疗器械注册有关事项中,信用A类且近一年内未有严重违法违规行为的企业可免于注册质量管理体系核查,或可在其申报的二类医用软件产品中探索简化审评等模式。
器械大湾区分中心 袁盛 朱鹏志 供稿
(转载自国家药品监督管理局医疗器械技术审评中心网站)